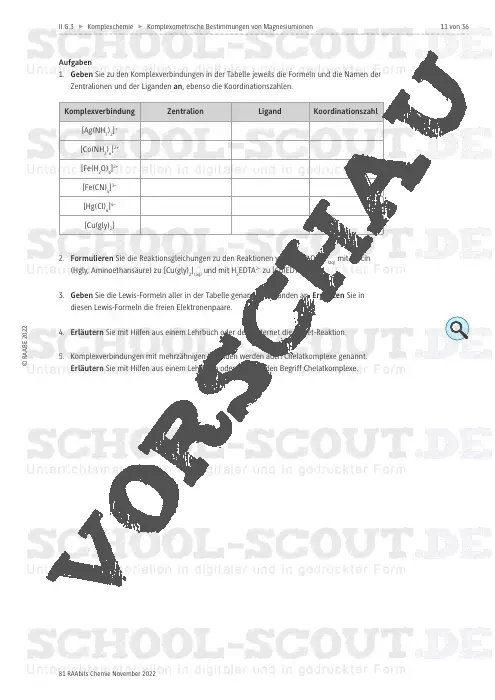
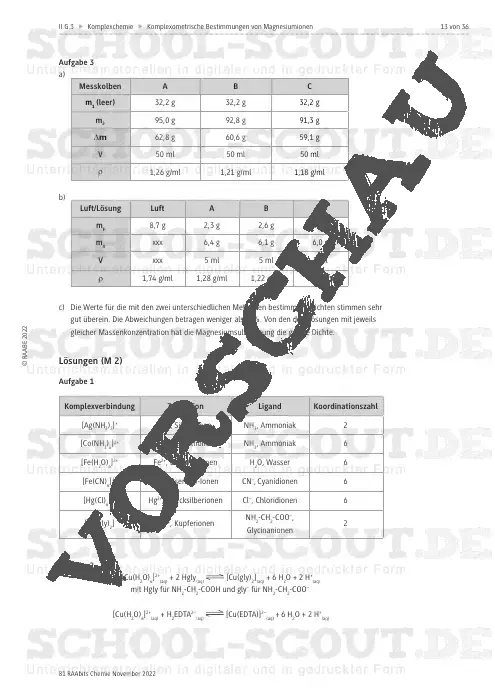
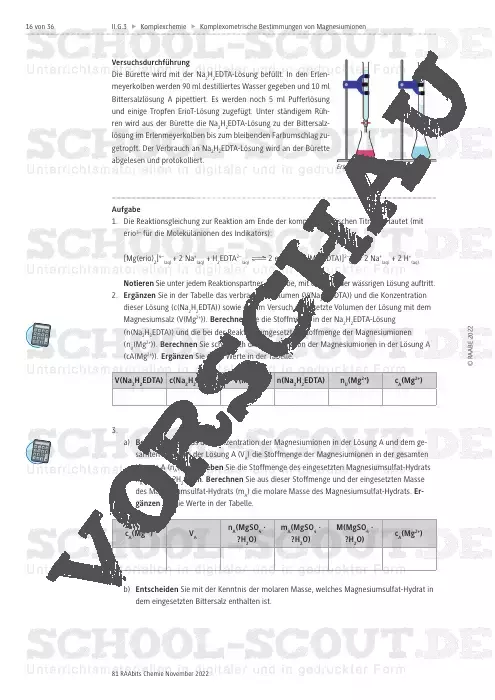
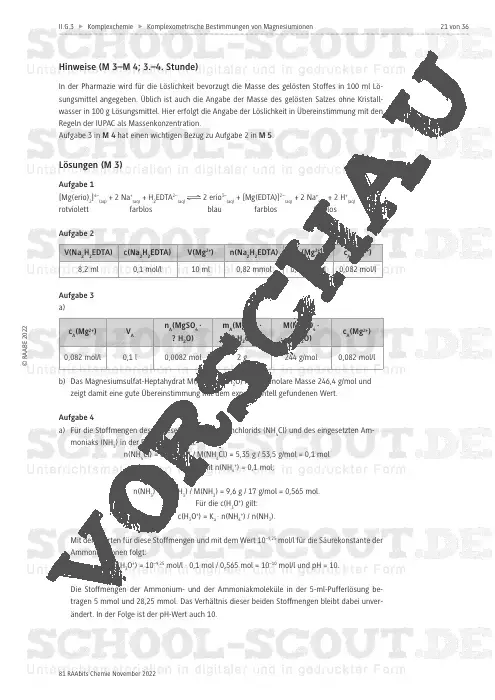
Komplexometrische Bestimmungen von Magnesiumionen in Bittersalzlösungen
Komplexchemie
- Typ:
- Unterrichtseinheit
- Umfang:
- 37 Seiten (1,8 MB)
- Verlag:
- RAABE
- Auflage:
- 1 (2022)
- Fächer:
- Chemie
- Klassen:
- 11-13
- Schulform:
- Gymnasium
Magnesiumsulfat ist das gängige Beispiel für ein in Wasser leicht lösliches Sulfat eines Erdalkalimetalls und daher im Chemieunterricht nahezu aller Jahrgangsstufen präsent. Mit der Bindung von Kristallwasser wird aus Magnesiumsulfat das Bittersalz Epsomit. Magnesiumsulfat hat als Düngemittel, Nahrungsergänzungsmittel und pharmazeutischer Wirkstoff einen breiten Anwendungsbereich. Die Neigung der Magnesiumionen zur Bildung von Ionenaggregaten zeigt sich schon mit der Ausbildung der Hydrathüllen der Ionen. Sie ist die Grundlage für die Bildung stabiler Chelatkomplexe und einer komplexometrischen Bestimmung.
KOMPETENZPROFIL:
- Klassenstufe: 11–13
- Dauer: 7 Unterrichtsstunden (Doppelstunden)
- Kompetenzen:
- 1. Gesetzmäßigkeiten und Theorien fachspezifisch beschreiben, anwenden und überprüfen.
- 2. Experimente nach Anleitungen durchführen, beschreiben und auswerten, Gefährdungspotenziale einschätzen.
- 3. Einsatz und Wirkung von Stoffen in der alltäglichen Anwendung reflektieren und beurteilen.
- Thematische Bereiche: Salze, Löslichkeit, Teilchenaggregate, koordinative Bindung,
Lösungsenthalpie, Prinzip vom kleinsten Zwang, pH-Wert, Puffer, komplexometrische Titration