46 Kopiervorlagen Anorganische Chemie
Arbeitsblätter Chemie für die Sekundarstufe
- Typ:
- Unterrichtseinheit
- Umfang:
- 97 Seiten (31,4 MB)
- Verlag:
- Duden Paetec
- Autor/in:
- Ernst, Christine / Hauschild, Günter / Liebner, Frank / Scheurell, Sven / Simon, Helga / Wehser, Adria
- Auflage:
- 1 (2008)
- Fächer:
- Chemie, Naturwissenschaft
- Klassen:
- 7-10
- Schulform:
- Gymnasium, Gesamtschule, Realschule
Die vorliegenden 46 Kopiervorlagen enthalten für die wesentlichen stofflichen Schwerpunkte der Anorganischen Chemie Aufgabenblätter sowie Anleitungen für Experimente, die bei der Behandlung der Sachverhalte im Chemieunterricht der verschiedenen Klassenstufen und Schultypen genutzt werden können.
Die Aufgaben der Aufgabenblätter sind innerhalb der Kapitel nicht nach dem Anforderungsniveau, sondern nach dem Inhalt geordnet. Einige Aufgaben enthalten mehrere Teilaufgaben. Sie verlangen von den Schülerinnen und Schülern eine höhere Komplexität in der Bearbeitung eines Sachverhalts. Die Teilaufgaben können von den Lernenden aber auch einzeln gelöst werden.
Die Arbeitsblätter der Reihe können zur Neuerarbeitung, Wiederholung, Systematisierung und Leistungsermittlung eingesetzt werden.
Alle 46 Arbeitsblätter enthalten in der Regel jeweils eine Aufgabenseite und eine Lösungsseite zu den Themen der Anorganischen Chemie:
- Stoffgemische
- Elementsubstanzen
- Verbindungen
- Reaktionsarten
Inhaltsverzeichnis:
- Stoffgemische
- Blatt 1: Stoffgemische und Reinstoffe
- Blatt 2: Luft – ein Stoffgemisch
- Blatt 3: Wässrige Lösungen in Natur und Haushalt
- Blatt 4: Herstellen von Lösungen
- Elementsubstanzen
- Metalle
- Blatt 5: Untersuchungen zu Metallen
- Blatt 6: Legierungen der Metalle
- Blatt 7: Bau und Eigenschaften der Metalle
- Blatt 8: Chemische Reaktion von Magnesium mit Sauerstoff (I)
- Blatt 9: Chemische Reaktion von Magnesium mit Sauerstoff (II)
- Nichtmetalle
- Blatt 10: Herstellung von Sauerstoff
- Blatt 11: Eigenschaften von Sauerstoff
- Blatt 12: Nachweis von Sauerstoff
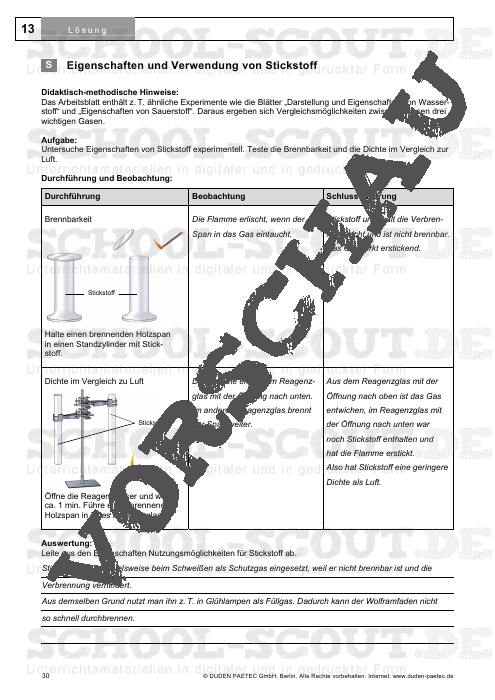
- Blatt 13: Eigenschaften und Verwendung von Stickstoff
- Blatt 14: Darstellung und Eigenschaften von Wasserstoff
- Blatt 15: Bau, Eigenschaften und Verwendung von Wasserstoff
- Blatt 16: Wasserstoff – die „Kohle“ von morgen?
- Blatt 17: Erhitzen von Schwefel
- Blatt 18: Kohlenstoff und seine Modifikationen
- Blatt 19: Chloratome – immer im Doppelpack
- Metalle
- Verbindungen
- Molekülsubstanzen
- Blatt 20: Steckbrief Kohlenstoffdioxid
- Blatt 21: Nachweis von Kohlenstoffdioxid
- Blatt 22: Die Oxide des Kohlenstoffs
- Blatt 23: Steckbrief Schwefeldioxid
- Blatt 24: Stickstoffmonoxid und Stickstoffdioxid
- Blatt 25: Wasser hat eine „Haut“
- Blatt 26: Nachweis von Wasser
- Blatt 27: Die Chemie des Wassers
- Blatt 28: Chlorwasserstoff
- Blatt 29: Steckbrief Ammoniak
- Blatt 30: Säuren und saure Lösungen
- Blatt 31: Von der Säure zur sauren Lösung
- Blatt 32: Indikator – selbst hergestellt
- Blatt 33: Reaktionen saurer Lösungen
- Ionensubstanzen
- Blatt 34: Kochsalz – unser „weißes Gold“
- Blatt 35: Vom Salz zur Lösung
- Blatt 36: Carbonate im Test
- Blatt 37: Calciumcarbonat – ein wichtiger Baustoff
- Blatt 38: Was ist drin? – Nachweis von Ionen
- Blatt 39: Natriumhydroxid und andere Metallhydroxide
- Blatt 40: Bildung von basischen Lösungen
- Oxide
- Blatt 41: Oxide im Test
- Molekülsubstanzen
- Reaktionsarten
- Redoxreaktion
- Blatt 42: Vom Metalloxid zum Metall
- Blatt 43: Von den Elementsubstanzen zur Verbindung
- Blatt 44: Reaktion mit Elektronenübergang – eine neue Reaktionsart?
- Reaktion mit Protonenübergang
- Blatt 45: Sauer + basisch = doppelt gefährlich?
- Blatt 46: Saure oder basische Reaktion?
- Redoxreaktion